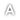1. Berdasarkan penilaian dan ujian makmal oleh Kementerian Kesihatan Malaysia (KKM) dan syarikat pemegang pendaftaran produk serta maklumat semasa daripada badan regulatori antarabangsa, setakat ini terdapat satu (1) produk lulus ujian impuriti NDMA dan tiga belas (13) produk yang telah dipanggil balik kerana melebihi had impuriti NDMA yang dibenarkan seperti yang disenaraikan dalam Jadual 1 dan 2.
Jadual 1: Produk yang lulus ujian impuriti NDMA (sehingga 29 November 2019)
|
Bil |
Nama Produk |
No Pendaftaran |
|
1 |
Arnetin 25mg/ml Injection |
MAL20033329AZ |
Jadual 2: Senarai Produk Ranitidine Berdaftar Yang Dipanggil Balik
|
Bil |
Nama Produk |
No Pendaftaran |
|
1 |
Zantac Injection 50mg/2ml |
MAL19950591ARZ |
|
2 |
Zantac Syrup 150mg/10ml |
MAL19910829ACRZ |
|
3 |
Hyzan Tablet 150mg |
MAL19984063AZ |
|
4 |
Vesyca Film Coated Tablet 150mg |
MAL19991131AZ |
|
5 |
Apo-Ranitidine 300mg tablet |
MAL19988448AZ |
|
6 |
Apo-Ranitidine 150mg tablet |
MAL19986966AZ |
|
7 |
Ranitic Tablet 150mg |
MAL19988460AZ |
|
8 |
Pharmaniaga Ranitidine Tablet 150 Mg |
MAL19987368AZ |
|
9 |
Pharmaniaga Ranitidine Tablet 300 Mg |
MAL19987370AZ |
|
10 |
Histac Tablet 150mg |
MAL19972524AZ |
|
11 |
Rantac Tablet 150mg |
MAL19991696AZ |
|
12 |
Rantac Tablet 300mg |
MAL20051293AZ |
|
13 |
X`Tac Tablet 150mg |
MAL19972537AZ |
Nota: Zantac Tablet 150mg (MAL19871471ARZ) yang dipanggil balik oleh Health Sciences Authority (HSA), Singapura tidak dipasarkan di Malaysia.
2. Kenyataan akhbar boleh dicapai melalui link di bawah:
3.Soalan-soalan Lazim (FAQ): Impuriti NDMA di dalam Produk Ranitidine boleh dicapai melalui link di bawah:
Soalan-soalan Lazim (FAQ) Impuriti NDMA di dalam Produk Ranitidine